Infos patients – Chirurgie cardiaque
Infos patients chirurgie cardiaque
Les spécialistes du département ont rédigé des fiches d’information dans le but de vous éclairer sur votre pathologie ou les techniques utilisées pour le traitement de celle-ci.
Ces fiches complètent l’information orale reçue en consultation.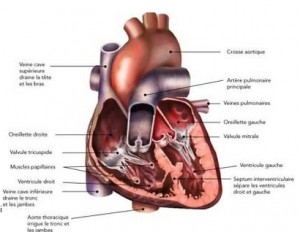 Le cœur est logé dans le thorax. Il est presque médian. Sa pointe est orientée vers le côte gauche et vers l’avant. De chaque côté, la région du cœur est occupée par les poumons.
Le cœur est logé dans le thorax. Il est presque médian. Sa pointe est orientée vers le côte gauche et vers l’avant. De chaque côté, la région du cœur est occupée par les poumons.
Le cœur est composé de 4 cavités :
- L’oreillette droite reçoit des veines caves supérieure et inférieure le sang veineux périphérique, qui se jette au travers de la valve tricuspide dans :
- Le ventricule droit qui en se contractant chasse le sang dans l’artère pulmonaire. L’artère pulmonaire est pourvue d’un clapet à trois valvules sigmoïdes dite valve pulmonaire. Le ventricule droit chasse le sang vers les poumon où il s’oxygènera. Le sang oxygéné retourne vers :
- L’oreillette gauche par les 4 veines pulmonaires ; se jette ensuite au travers de la valve mitrale
- Le ventricule gauche qui en se contractant chasse le sang dans l’aorte ; est aussi pourvu d’un système anti-reflux fait de trois valvules dit valve aortique.
Le cœur est une pompe musculaire qui pour fonctionner doit s’approvisionner en oxygène et en éléments nutritifs, qu’il reçoit des artères coronaires.
Les artères coronaires
Les artères coronaires naissent de la base de l’aorte au niveau d’orifices appelés ostia. Ils sont au nombre de deux :
- Artère coronaire gauche : c’est la plus importante des deux coronaires naissant de la face antéro-gauche de l’aorte au-dessus de la valve aortique. Ce tronc coronaire gauche mesure entre 0,5 et 2 cm, il se divise ensuite en deux branches principales : l’artère interventriculaire antérieure et l’artère circonflexe.
- L’artère coronaire droite : elle prend naissance sur la partie antéro-droite de l’aorte au-dessus de la valve aortique. Elle donne de nombreuses branches collatérales. Dans son segment terminal, la coronaire droite se divise en artère rétroventriculaire et en artère intraventriculaire postérieure.
L’aorte
Elle est divisée anatomiquement en deux parties : l’aorte thoracique et l’aorte abdominale.
L’aorte thoracique est divisée en :
- L’aorte ascendante, qui constitue le segment initial de l’aorte. Elle émerge du ventricule gauche, dont elle est séparée par la valve aortique. Les artères coronaires naissent de cette portion.
- L’aorte horizontale ou crosse aortique, trois vaisseaux naissent de cette crosse aortique, et irriguent la tête et les bras.
- L’aorte descendante.
La chirurgie cardiaque a connu un essor fulgurant dans les deux dernières décennies,
et se pratique maintenant de manière courante avec des résultats fiables et
reproductibles.
Cette chirurgie reste une agression physiologique importante, en raison de la taille de
l’incision, l’utilisation de la circulation extra corporelle et le fait d’arrêter le coeur en le
protégeant pendant sa réparation.
Ce sont de récentes innovations technologiques portant sur les instruments et sur les
techniques de la circulation extra corporelle, qui ont permis de pratiquer certaines de
ces opérations cardiaques par des méthodes vidéoscopiques et donc de moins en
moins agressives.
1- Chirurgie coronaire
La chirurgie des artères coronaires connaît depuis quelques années des changements
qui sont liés aux progrès des techniques chirurgicales, et aux nouvelles générations de
stents enrobés de substance active.
La pathologie coronarienne a été responsable d’un peu plus de 298 000 hospitalisations
en France métropolitaine en 2001, dont 126 700 pour angine de poitrine et 92 800 pour
infarctus ou ischémie aiguë du myocarde. Cela correspond à 22% des hospitalisations
pour maladies cardiovasculaires
 Le développement des traitements par voie percutanée est passé de 52 400 en 1993 à
Le développement des traitements par voie percutanée est passé de 52 400 en 1993 à
116 600 en 2001. Ce mode d’intervention a pratiquement triplé durant cette période, passant de 53 à 157 pour 100 000 personnes.
Le recours aux interventions chirurgicales a peu varié sur la même période.
Mais si le nombre de pontages pratiqués a tendance à se stabiliser, leur mode de réalisation a changé.
En 1993, 71% des interventions n’utilisaient que les pontages veineux. En 2001, 13% des pontages sont des pontages veineux, 22% des pontages uniquement mammaires, 49% des associations de pontages mammaires internes et de pontages veineux. La meilleure perméabilité des pontages mammaires explique que cette technique soit actuellement préférentiellement choisie.
Ces facteurs ont modifié la prise en charge des patients coronariens dits chirurgicaux
en élargissant l’éventail thérapeutique réalisable, soit au travers d’une sternotomie
classique, soit au travers de mini incisions, soit de façon totalement endoscopique.
Actuellement, la revascularisation chirurgicale complète sous circulation extracorporelle
à coeur arrêté reste la technique de référence pour les patients à faible risque
opératoire.
D’autres techniques chirurgicales peuvent être associées à un geste d’angioplastie : on
parle alors de » procédures hybrides « . (Par « procédures hybrides », on désigne des
moyens thérapeutiques par lesquels une revascularisation peut être complète en
combinant l’angioplastie à un geste chirurgical avec ou sans circulation extra-corporelle)
Le but actuel de ces méthodes qui s’adressent à des patients dont l’état est de plus en
plus sévère, est de pouvoir effectuer une revascularisation la plus complète possible
avec un taux de complications et d’échec le plus faible possible.
Les résultats immédiats sont en général excellents avec une très faible mortalité et
morbidité opératoire, mais à distance, on peut observer de nouveaux rétrécissements
au niveau des stents nécessitant de nouvelles angioplasties
La robotique
Permet de réduire la taille des incisions et aider le chirurgien pour la dissection des artères mammaires et la réalisation de l’anastomose coronaire par voie totalement endoscopique.
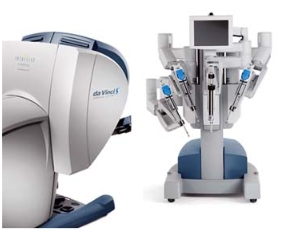 Ce robot est constitué d’une console reliée à une caméra donnant une vision 3D et à deux bras de 5 mm de diamètre télé manipulés à distance. Un stabilisateur endoscopique est placé par voie sous xiphoïdienne. L’intervention est entièrement réalisée au travers de ces 4 orifices.
Ce robot est constitué d’une console reliée à une caméra donnant une vision 3D et à deux bras de 5 mm de diamètre télé manipulés à distance. Un stabilisateur endoscopique est placé par voie sous xiphoïdienne. L’intervention est entièrement réalisée au travers de ces 4 orifices.
Un scanner cardiaque spiralé réalisé en préopératoire permet d’optimiser le placement des instruments.
Tous les pontages sont faits sans circulation extra corporelle à coeur battant.
Ces nouvelles techniques, en offrant le même résultat, simplifient les suites opératoires,
diminuent l’hospitalisation et la réadaptation et réduisent le coût total de la prise en
charge.
2-Chirurgie valvulaire
Chirurgie fréquente et réglée. Elle se fait par strenotomie et l’emploi d’une circulation
extra corporelle est nécessaire pour procéder à leur traitement.
Ces valves du coeur peuvent soit se rétrécir parfois en se calcifiant (surtout la valve
aortique) soit se mettre à fuir (surtout la valve mitrale ou tricuspide).
Leur traitement consiste le plus souvent à les remplacer mais il est parfois possible de
les réparer sans avoir à les changer et c’est le cas de la valve mitrale lorsque les
causes de la fuite le permettent.
Pour les remplacer on utilise des prothèses valvulaires qui sont de deux types : les
valves mécaniques qui sont inaltérables mais qui nécessitent de prendre a vie un
traitement anticoagulant et des prothèses dites biologiques qui sont construites à partis
de tissus animaux spécialement traités qui elles ne sont pas inusables mais qui ne
nécessitent pas la prise d’un traitement anticoagulant à vie.
Etre porteur d’une valve permet au coeur de fonctionner normalement mais c’est un
corps étranger et à ce titre il est très important de prévenir tout risque d’infection en le
traitant par des antibiotiques des sa suspicion.
La surveillance de ces valves doit être régulière et l’échographie est la méthode de
référence
La robotique
La chirurgie valvulaire peut aussi être pratiquée au travers de petites incisions dans le
but de diminuer la morbidité.
Cette chirurgie nécessite d’utiliser de toute façon une circulation extra-corporelle qui est
alors établie par voie percutanée périphérique
La technique opératoire repose sur un abord de la valve à réparer ou à changer par une
mini thoracotomie droite de 5 cm. Cet orifice permet d’introduire la caméra qui permet une vision en 3D. Les instruments sont introduits par deux petites incisions de 5 mm de
part et d’autre de l’incision.
Le geste valvulaire est alors réalisé selon les même principes chirurgicaux
Ces instruments endoscopiques reliés au télémanipulateur permettent d’obtenir 7
degrés de liberté ce qui rend la réparation valvulaire ou la mise en place de la valve
plus aisée que par méthode vidéoscopique seule qui n’a pas ces même degrés de
libertés.
Les patients proposés à cette chirurgie mini invasive sont pour le moment sélectionnés :
des patients jeune sans morbidité associé et ayant besoin d’un geste de réparation
valvulaire simple.
L’avantage évident est la diminution de la douleur, un retour à domicile et à une vie
fonctionnelle plus rapide.
Ces techniques s’intègrent, comme nous l’avons vu avec l’essor de l’angioplastie, dans
une évolution naturelle et incontournable qui tend à améliorer la qualité de la chirurgie
et a réduire la durée d’hospitalisation.

La chirurgie valvulaire mitrale est représentée par le remplacement et la plastie, pour traiter soit :
- Un rétrécissement mitral
- Une insuffisance mitrale
1. Rétrécissement mitral
Une valve mitrale sténotique représente un obstacle au flux sanguin provenant des poumons. Les causes du rétrécissement mitral sont rhumatismales : le rhumatisme articulaire aigu est la cause quasi exclusive du rétrécissement mitral. L’inflammation chronique aboutit à une fibrose progressive et à l’apparition de calcifications. La fusion de bords libres de la valve est à l’origine d’une obstruction prépondérante.
2. Insuffisance mitrale
Si les deux feuillets de la valve mitrale ne se ferment pas complètement (insuffisance mitrale), une quantité de sang à chaque pulsation du cœur rétrograde vers l’oreillette gauche et le poumon.
Les causes de l’insuffisance mitrale sont :
- Dégénératives : elles représentent plus de 50% de cas opérés actuellement et surviennent chez le sujet àgé.
- Rhumatismales : autrefois étiologie dominante des insuffisances mitrales elles représentent encore 30-40% des cas opérés.
- Par prolapsus d’un ou des feuillets valvulaires : la valve mitrale ne se ferme pas correctement par cause d’une élongation ou d’une rupture de l’appareil sous valvulaire.
- Infectieuses : endocardite mitrale, processus infectieux de la valve avec destruction et perforation.
- Ischémiques : insuffisance mitrale ischémique survient dans les cas de cardiopathie ischémique et peut être aussi la complication d’un infarctus.
Quels sont les signes d’une valve mitrale qui dysfonctionne?
Une valve mitrale pathologique peut donner une variété de symptômes comme :
- Fatigue, le cœur ne peut pas augmenter l’apport sanguin nécessaire à l’effort donc la fatigue survient pour des efforts non importants.
- Essoufflement (dyspnée), principalement à l’effort.
- Palpitations, la perception désagréable du rythme cardiaque.
Quelles sont les options chirurgicales ?
Elles sont au nombre de deux :
- Plastie de la valve mitrale, c’est une reconstruction chirurgicale de la valve mitrale pathologique.
- Remplacement de la valve mitrale
La décision du remplacement ou de reconstruction est fonction de la nature et de la gravité des lésions.
Plastie de la valve mitrale :
 Il y a des pathologies mitrales pour lesquelles on peut espérer une réparation de la valve.
Il y a des pathologies mitrales pour lesquelles on peut espérer une réparation de la valve.
La pathologie dégénérative ainsi que le prolapsus mitral sont des bonnes indications de plastie.
L’endocardite de la valve est une autre pathologie qui peut être traitée par un geste de valvuloplastie.
Un écho-cardiogramme fait en pré-opératoire aide le chirurgien à évalué la possibilité ou non d’un geste conservateur sur la valve mitrale.
Remplacement de la valve mitrale :
 Il existe des cas où la valve mitrale est trop atteinte et ne peut pas être réparée. Un remplacement de la valve mitrale est alors nécessaire avec une valve prothétique artificielle.
Il existe des cas où la valve mitrale est trop atteinte et ne peut pas être réparée. Un remplacement de la valve mitrale est alors nécessaire avec une valve prothétique artificielle.
Une fois la décision d’une remplacement valvulaire mitrale prise, le choix se porte sur le type de la valve prothétique à choisir. Ils existe deux catégories de valve prothétiques :
Les valves mécaniques ont une durée excellente. L’inconvénient principal de ce type de valve est qu’elle nécessite une anticoagulation à vie pour avoir un fonctionnement correct.
Les valves biologiques nécessitent une anticoagulation de 3 mois après l’intervention, période après on pourra arrêter toute anticoagulation. L’inconvenient principal est la détérioration au cours du temps. Les donnes actuelles font penser que la durée de vie moyenne d’une bioprothèse en position mitrale est de 15 ans.
La décision du type de valve utilisée est à prendre en commun accord entre vous, votre chirurgien et votre cardiologue.
Les résultats après chirurgie de la valve mitrale sont excellents
En cas de plastie de la valve mitrale la mortalité hospitalière est proche de zéro.
En cas de remplacement de la valve mitrale la mortalité hospitaliere est de l’ordre de 3-4%
La survie à 5 ans en cas de plastie est supérieure 90% ; la survie à 5 ans en cas de remplacement est de l’ordre de 85%
Le post-opératoire d’un remplacement mitrale ou plastie de la valve mitrale?
Après chirurgie valvulaire mitrale, une surveillance dans le service de réanimation en chirurgie cardiaque est nécessaire pour au moins 48 h. Après cela, vous passez en salle dans le service de chirurgie cardiaque où vous restez pour une période de 7 à 10 jours. Durant ce séjour en salle, les cicatrices sont surveillées et le traitement médical établi. Cette période est suivie d’une hospitalisation de 15 à 20 jours en réadaptation cardiaque avant la sortie à domicile.
Tous les patients opérés d’un remplacement valvulaire nécessitent au moins 3 mois d’anticoagulation pour les valves biologiques et pour la plastie de la valve mitrale, et à vie pour les valves mécaniques.
Tous les patients doivent prendre une antibiotique chaque fois qu’ils nécessitent un traitement dentaire ou autre chirurgie. Ils doivent renseigner leur médecin traitant qu’ils sont porteurs d’une valve.
Un anévrysme aortique est une dilatation anormale du plus gros vaisseaux de l’organisme humain : l’aorte.
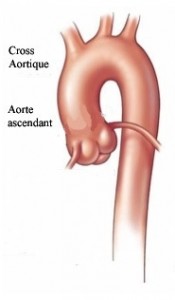 L’aorte est un vaisseau d’un diamètre d’environ 3 cm. Cette artère est chargée d’apporter le sang à partir du cœur au reste de l’organisme. Un anévrysme de l’aorte peut se développer sur toute la portion de l’aorte. Le chirurgien cardiaque prend en charge les anévrysmes de la portion aortique qui se trouve à l’intérieur du thorax. Un anévrysme de l’aorte peut être comparé à un ballon gonflé. Plus il est gonflé, plus les risques de rupture augmentent. Si vous êtes porteur d’une telle pathologie, le cardiologue ou le chirurgien cardiaque peut vous conseiller sur le moment pour intervenir de façon à prévenir les risques de rupture.
L’aorte est un vaisseau d’un diamètre d’environ 3 cm. Cette artère est chargée d’apporter le sang à partir du cœur au reste de l’organisme. Un anévrysme de l’aorte peut se développer sur toute la portion de l’aorte. Le chirurgien cardiaque prend en charge les anévrysmes de la portion aortique qui se trouve à l’intérieur du thorax. Un anévrysme de l’aorte peut être comparé à un ballon gonflé. Plus il est gonflé, plus les risques de rupture augmentent. Si vous êtes porteur d’une telle pathologie, le cardiologue ou le chirurgien cardiaque peut vous conseiller sur le moment pour intervenir de façon à prévenir les risques de rupture.
La dissection aortique correspond à une déchirure de l’intima provoquant la séparation entre les feuillets interne et externe de la media créant un faux chenal dans la paroi aortique dans lequel le sang circule. Elle est alors très fragile.
C’est une urgence lorsqu’elle intéresse l’aorte ascendante. La mortalité à 48h est de l’ordre de 50 % et presque 90 % des patients ne survivent pas 1 mois. Quand la première partie dite aorte ascendante, et la partie horizontale dite crosse aortique qui donnent naissance aux vaisseaux à destinée cérébrale sont frappées par une dissection, une indication chirurgicale en urgence est nécessaire.
L’anévrysme de l’aorte ascendante comme la dissection de la crosse aortique sont traités par des techniques proches. L’aorte est abord abordée par sternotomie et la portion pathologique est remplacée par un tube synthétique de Dacron. La dissection de l’aorte descendante est une urgence médicale. En effet, les risques et traitements médicaux par des médicaments qui baissent la tension aortique et luttent contre la douleur sont efficaces et ne nécessitent pas toujours une intervention chirurgicale. Depuis quelques années, les traitements par endoprothèse sont proposés commeoption thérapeutique.
La chirurgie de remplacement de la valve aortique est une chirurgie valvulaire très pratiquée. Il s’agit d’une opération à cœur ouvert pour traiter :
- soit un rétrécissement aortique (une valve sténotique),
- soit une insuffisance aortique (une fuite valvulaire au niveau de la valve aortique).
Le rétrécissement aortique
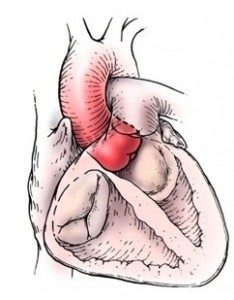 Le rétrécissement aortique provoque un obstacle à l’éjection du ventricule gauche. Les causes du rétrécissement aortique sont :
Le rétrécissement aortique provoque un obstacle à l’éjection du ventricule gauche. Les causes du rétrécissement aortique sont :
-
dégénératives ou valvulopathie aortique sénile, avec fibrose, calcification et fusion des commissures aortiques. C’est la forme la plus fréquente des rétrécissements aortiques du patient âgé .
- congénitale : il s’agit d’une anomalie présente chez 1 à 2 % de la population générale. Cette valve peut fonctionner correctement pendant plusieurs années pour devenir sténotique entre 50 et 70 ans.
- rhumatismales, de plus en plus rare du fait de la quasi disparition du rhumatisme articulaire dans les pays développés.
L’insuffisance aortique
L’insuffisance aortique se produit lorsque les valves ne se ferment pas complètement. Les principales causes des insuffisances aortiques sont :
- une maladie annulo-ectasiante, c’est devenu l’étiologie la plus fréquente. Elle touche à la fois la valve et la premier portion de l’aorte ascendante.
- un rhumatisme articulaire aigu, souvent associé à une sténose aortique.
- une bicuspidie aortique congénitale, souvent associée à une sténose aortique.
- une endocardite infectieuse, mutilation de la valve aortique dû à un processus infectieux.
Quels sont les signes d’une valve aortique qui dysfonctionne ?
Les symptômes sont variés : difficulté à respirer, douleurs thoraciques angineuses, vertiges (lipothymie) pouvant conduire à la perte de conscience (syncope).
Quant faut-il opérer ?
La décision est prise en accord avec votre cardiologue traitant et le chirurgien cardio-thoracique. Les recommandations pour l’intervention se fondent sur la symptomatologie, les résultats de l’échographie et parfois du cathétérisme cardiaque.
Quelles sont les options ?
Une fois prise la décision d’opérer, il faut choisir le type de la valve prothétique entre les valves mécaniques et les bioprothèses.
 Les valves mécaniques ont une durée excellente, mais impliquent une anticoagulation à vie.
Les valves mécaniques ont une durée excellente, mais impliquent une anticoagulation à vie.
Les valves biologiques ne nécessitent une anticoagulation que de 3 mois après l’intervention mais se détériorent avec le temps.  Selon les données actuelles, la durée de vie d’une bioprothèse en position aortique impliquen que 20% d’entre elles sont réopérées entre 15 et 18 ans après leur implantation.
Selon les données actuelles, la durée de vie d’une bioprothèse en position aortique impliquen que 20% d’entre elles sont réopérées entre 15 et 18 ans après leur implantation.
La décision concernant le type de valve est à prendre en commun accord entre vous, votre chirurgien et votre cardiologue.
Résultats du remplacement valvulaire aortique :
Une estimation du risque opératoire individuel peut être fait par votre cardiologue ou le chirurgien cardiaque. Les risques dépendent de votre âge, de votre état général et d’autres facteurs comme l’état de votre cœur avant l’intervention.
La période post-opératoire d’un remplacement valvulaire aortique
Après un remplacement valvulaire aortique, une surveillance dans le service de réanimation en chirurgie cardiaque est nécessaire. Après cela, un séjour dans le service de chirurgie cardiaque est à prévoir pour une période de 7 à 10 jours pendant laquelle les cicatrices sont surveillées et le traitement médical nécessaire établi. S’ensuit une période de réadaptation cardiaque de 15 à 20 jours dans un centre spécialisé.
Tous les patients opérés d’un remplacement valvulaire nécessitent au moins 3 mois d’anticoagulation pour les valves biologiques, et à vie pour les valves mécaniques.
Une valve est un corps étranger et c’est pour éviter l’infection qu’est prescrit un antibiotique à chaque traitement dentaire ou chirurgical, ou à chaque infection débutante. Les patients doivent renseigner leur médecin traitant qu’ils sont porteurs d’une valve.
La pathologie coronaire
Artériosclérose :
Terme désignant l’épaississement de la paroi artérielle, causée par une accumulation locale de dépôts lipidiques, responsable d’un rétrécissement du calibre de l’artère pouvant aller jusqu’à l’obstruer.
Angine de poitrine :
Est un syndrome douloureux thoracique en rapport avec une insuffisance du débit coronaire face aux besoins en oxygène du myocarde. Si la crise est prolongée, il est impératif d’appeler un médecin en urgence (faire le 15) car elle peut être la cause de l’infarctus du myocarde.
L’artériosclérose
Cause essentielle de l’ischémie myocardique est la cardiopathie la plus fréquente. Elle touche 22% des hommes avant 65 ans. Les facteurs de risques connus sont :
- Hérédité
- Hypertension artérielle.
- Dyslipidémie
- Obésité
- Diabète
- Tabagisme
- Sexe masculin
- Sédentarité
- Apnée du sommeil
 Si vous avez une symptomatologie susceptible d’être une angine de poitrine, et si vous avez un ou plusieurs facteurs de risques, une visite chez votre cardiologue est souhaitable pour essayer de dépister une possible coronaropathie.
Si vous avez une symptomatologie susceptible d’être une angine de poitrine, et si vous avez un ou plusieurs facteurs de risques, une visite chez votre cardiologue est souhaitable pour essayer de dépister une possible coronaropathie.
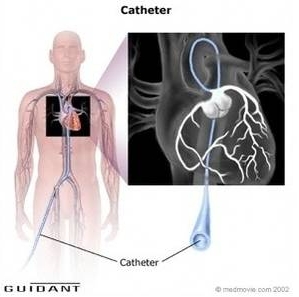
Votre cardiologue, s’il le juge nécessaire, peut procéder à des tests non invasifs comme l’életrocardiogramme (ECG), életrocardiogramme d’effort pendant lequel votre cœur est monitoré pendant que vous faites un effort en crescendo. Autres tests d’effort ou apparentés sont la scintigraphie myocardique et l échographie de stress.
Si un doute apparaît à l’issue de ces épruves, une coronarographie sera nécessaire pour visualiser directement les artères coronaires. Un petit cathéter est introduit dans l’artère fémorale ou l’artère radiale, jusqu’au niveau des artères coronaires et un produit de contraste est injecté directement à l’intérieur. Un radiocinema est réalisé pour visualiser directement les artères coronaires.
Traitement de l’angine de poitrine- techniques de revascularisation
- Angioplastie coronaire percutanée : cette technique consiste, au cours de la coronarographie, à gonfler un ballonnet au niveau d’une sténose coronaire pour la dilater. Le plus souvent, ce geste est complété par la mise en place d’un treillis métallique, maintenant le vaisseau ouvert après angioplastie, appelé « stent » ou endoprothèse coronaire. Cette technique a fait diminuer la fréquence des re-sténoses. Il existe actuellement des « stents » dits actifs, imprégnés par des traitements spécifiques anti re-sténoses.
- Pontage aorto-coronarien
Quand une intervention de pontage aorto-coronarien est-elle nécessaire ?
 D’un point de vue théorique, les indications courantes de revascularisation par pontage aorto-coronariens sont d’une part les situations dans lesquelles le traitement médical se trouve en échec, et d’autre part la sténose du tronc commun, les lésions tritronculaires ou équivalentes et une altération de la fonction ventriculaire gauche. Ces situations sont donc des indications chirurgicales classiques.
D’un point de vue théorique, les indications courantes de revascularisation par pontage aorto-coronariens sont d’une part les situations dans lesquelles le traitement médical se trouve en échec, et d’autre part la sténose du tronc commun, les lésions tritronculaires ou équivalentes et une altération de la fonction ventriculaire gauche. Ces situations sont donc des indications chirurgicales classiques.
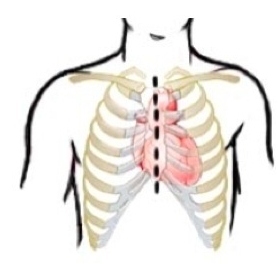
 L’accès au cœur se fait à travers la paroi antérieure du thorax. En effet, l’incision se fait sur la ligne médiane à travers le sternum (sternotomie). Cet accès permet au chirurgien cardiaque d’avoir un contrôle direct sur le cœur et sur les gros vaisseaux. Dans la majeure partie des cas, le patient est connecté au circuit de circulation extra-corporelle (CEC) le cœur est arrêté pendant que l’équipe chirurgicale pratique l’intervention sur les artères coronaires. Une fois l’intervention terminée, le patient est sevré de la CEC et son cœur bat de nouveau.
L’accès au cœur se fait à travers la paroi antérieure du thorax. En effet, l’incision se fait sur la ligne médiane à travers le sternum (sternotomie). Cet accès permet au chirurgien cardiaque d’avoir un contrôle direct sur le cœur et sur les gros vaisseaux. Dans la majeure partie des cas, le patient est connecté au circuit de circulation extra-corporelle (CEC) le cœur est arrêté pendant que l’équipe chirurgicale pratique l’intervention sur les artères coronaires. Une fois l’intervention terminée, le patient est sevré de la CEC et son cœur bat de nouveau.
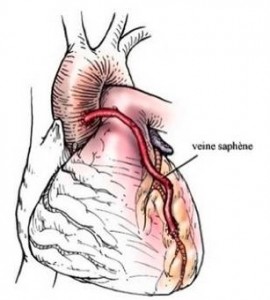
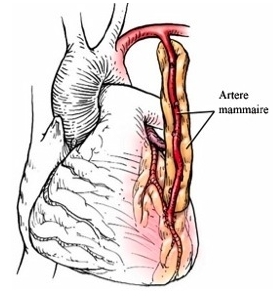 Les greffons utilisés pour faire les pontages sont les artères mammaires internes, la veine saphène interne et l’artère radiale.
Les greffons utilisés pour faire les pontages sont les artères mammaires internes, la veine saphène interne et l’artère radiale.
Les artères mammaires internes gauche et droite sont situées à l’intérieur du thorax. Pour des raisons anatomiques, on utilise en premier l’artère mammaire interne gauche puis la droite. La veine saphène située dans la partie interne du membre inférieur a l’avantage d’avoir une longueur exceptionnelle et est aussi très fréquemment utilisée. On peut enfin utiliser l’artère radiale, située dans l’avant-bras.
Depuis sa naissance dans les années 60 jusqu’à aujourd’hui, la chirurgie coronaire a connu une évolution considérable. En effet, les chirurgiens cardiaques ont sans cesse amélioré la technique et diminué l’agressivité de l’intervention. La chirurgie coronaire moderne utilise de plus en plus des conduits artériels. L’agressivité de l’intervention peut aussi être réduite, soit en éliminant la CEC et en faisant des pontages aorto-coronariens à cœur battant, ou en diminuant la taille de l’incision sternale.
Pontage aorto coronarienne à cœur battant :
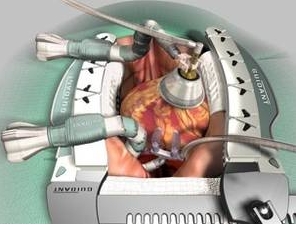 La technique du pontage à cœur battant est différente du pontage classique car le cœur continue à battre durant l’opération. La difficulté technique réside dans le fait de réussir à immobiliser la partie du cœur à opérer. L’immobilisation des sites des pontages fait appel à des instruments spécialement conçus à cet effet pour atténuer les mouvements du muscle cardiaque dit stabilisateurs. Les études récentes ont montré que les patients opèrés avec cette technique sont moins transfusés, nécessitent moins de drogues inotropes, souffrent moins d’infection respiratoire ; la ventilation artificielle post opératoire est moins prolongée, la permanence en réanimation et les arytmies post-opératoires sont moindres.
La technique du pontage à cœur battant est différente du pontage classique car le cœur continue à battre durant l’opération. La difficulté technique réside dans le fait de réussir à immobiliser la partie du cœur à opérer. L’immobilisation des sites des pontages fait appel à des instruments spécialement conçus à cet effet pour atténuer les mouvements du muscle cardiaque dit stabilisateurs. Les études récentes ont montré que les patients opèrés avec cette technique sont moins transfusés, nécessitent moins de drogues inotropes, souffrent moins d’infection respiratoire ; la ventilation artificielle post opératoire est moins prolongée, la permanence en réanimation et les arytmies post-opératoires sont moindres.
Chirurgie cardiaque mini invasive :
En suivant l’exemple d’autres spécialités chirurgicales, la chirurgie cardiaque a adopté des techniques moins invasives pour essayer de diminuer l’agression donc la taille de l’incision. De récentes innovations technologiques ont permis de pratiquer des pontages aorto coronaires par des méthodes moins invasives. En chirurgie de pontage coronaire, du fait de l’impossibilité de réaliser des sutures de microchirurgie par une vision endoscopique en deux dimensions, le processus a commencé par l’utilisation de la chirurgie vidéoassistée pour le prélèvement de l’artère mammaire interne gauche associant une minithoracotomie pour la réalisation des anastomoses coronaires en vision directe (MIDCAB).
La réalisation de pontage aortocoronaire par voie totalement endoscopique (TECAB) est devenu possible grâce à l’aide d’un télémanipulateur robotique qui permet la réalisation d’anastomoses coronaires en vision 3D et avec instruments adaptés à la microchirurgie.
Les techniques MIDCAB et TECAB ont leurs propres limites :
- elles ne permettent pas la réalisation de tout type de pontage
- la difficulté technique de télémanipuler des instruments
- un coût d’utilisation très élevé
Ces limites empêchent la diffusion généralisée de cette technique qui est pour cela proposée à un nombre restreint de patients .
Quelles sont les risques d’une chirurgie aorto coronarienne ?
Une estimation du risque opératoire individuel peut être fait par votre cardiologue ou le chirurgien cardiaque. Les risques dépendent de votre âge, de votre état général et d’autres facteurs comme l’état de votre cœur avant l’intervention.
Résultats de la chirurgie aorto coronarienne
Les résultats après un pontage aorto coronarienne sont excellents.
- 90 % de pontages réalisés avec l’artère mammaire interne sur l’artère inter ventriculaire anterieure sont perméables après 20 ans.
- 70 % des pontages realisés avec la veine saphène sont perméables après 15 ans.
- Environ 90% des patients ne présentent pas d’angor à 5 ans et 60% à 15 ans de l’intervention.
Quelles sont les conditions de vie après un pontage aortocoronarien ?
Après une chirurgie de pontage aorto-coronarien, la symptomatologie angineuse doit disparaître. Des douleurs liées à la sternotomie peuvent être ressenties quelque temps après l’intervention. A noter que la sternotomie n’est pas très douloureuse, et que la plupart des patients opérés ainsi ne sont pas plus gênés par les douleurs post-opératoires après les 2-3 jours suivant après l’intervention.
Une surveillance dans le service de réanimation en chirurgie cardiaque est nécessaire pour au moins 48 h. Après cela, le patient est transféré en service d’hospitalisation dans le service de chirurgie cardiaque pour une période de 7 à 10 jours pendant lesquels les cicatrices sont surveillées et le traitement médical adapté établi. Cette période est suivie d’une hospitalisation de 15 à 20 jours en réadaptation cardiaque avant le retour au domicile.
Quelques conseils :
L’hospitalisation pour un Cathétérisme cardiaque se fait en général la veille de
l’intervention pour permettre un bilan : examen clinique, bilan sanguin, radiographie
thoracique, électrocardiogramme.
L’exploration dure environ 1 à 2 heures. Le résultat de l’examen vous sera
communiqué par le médecin. La sortie est autorisée le lendemain ou surlendemain si
une angioplastie coronaire a été effectuée.
Voici quelques recommandations médicales auxquelles nous vous demandons de
bien vouloir prêter attention :
– Si le traitement que vous prenez quotidiennement comprend de l’aspirine,
vous pouvez poursuivre ce médicament même le jour de votre hospitalisation.
– Si vous êtes sous traitement anti-coagulant (Sintrom, Préviscan, Coumadine),
téléphonez à votre cardiologue ou dans le département de Pathologie cardiaque
(01.56.61.65.07) afin qu’un cardiologue vous conseille.
Enfin, pensez à apporter avec vous lors de votre hospitalisation tous les documents
même anciens en votre possession pouvant avoir un rapport avec votre maladie
(E.C.G., échocardiogramme, radios, carte de groupe sanguin, examens biologiques,
comptes-rendus médicaux, films de coronarographie) ainsi que votre carnet de
santé.
Qu’est ce qu’une salle hybride ?
Une salle hybride associe les qualités d’une salle d’opération et d’une salle de radiologie. Elle permet aux médecins de réaliser en un seul temps des traitements combinés et multiples sur le même patient. Cette salle qui est classée ISO 5 est la norme recommandée au bloc opératoire. Elle est obtenue à l’aide d’un flux unidirectionnel à haut volume. Elle est équipée d’une table d’opération mais également d’un arceau de radiologie. La même table peut servir en même temps de table de radiologie ou de table d’opération en fonction de l’intervention programmée. Un pupitre de commande centralisé permet de contrôler la gestion des flux d’images et des dispositifs médicaux. Elle est également équipée d’un système de visioconférence.
Pourquoi une salle hybride ?
La cardiologie interventionnelle et la chirurgie cardiaque permettent toutes deux de traiter et de réparer le cœur. Traditionnellement la chirurgie se fait au travers d’incisions alors que l’angioplastie est pratiquée en passant par les artères ou les veines sans effectuer d’incisions.
De nouvelles techniques associant les techniques de chirurgie cardiaque conventionnelle aux techniques de cardiologie et radiologie interventionnelle sont apparues grâces à la miniaturisation des instruments.
Il est par exemple possible de pratiquer un ou deux pontages coronaires par voie vidéoscopique et de pratiquer la pose d’un stent sur une autre artère coronaire chez le même patient au cours de la même intervention. Cela revient à pratiquer un triple pontage mais sans les inconvénients liés à l’ouverture et au stress opératoire.
D’autres techniques moins traumatisantes existent permettant de placer des valves aortiques par voie transfémorale, ou par de petites incisions cutanées (mini-incision thoracique) sous contrôle des rayons X et de l’échographie. Cette technique permet de traiter des patients à haut risque opératoire ou considérés comme inopérables par voie chirurgicale classique.
D’autres pathologies comme les anévrysmes ou les dissections de l’aorte thoracique ou abdominale peuvent être traitées par des prothèses endovasculaires.
Enfin certaines opérations sont possibles pour traiter l’arythmie cardiaque (fibrillation auriculaire) associant une approche vidéoscopique à une approche transfémorale afin de restaurer un rythme sinusal régulier.
Toutes ces interventions nécessitent une salle hybride qui permet une excellente visualisation radiologique et une sécurité opératoire indispensable. Cela permet de réaliser ou de développer des techniques innovantes rendant possible des interventions par des équipes de chirurgiens et médecins, tout en facilitant le geste de l’un ou de l’autre.