Infos patients – Chirurgie Thoracique
Informations patients chirurgie thoracique
Les spécialistes du département ont rédigé des fiches d’information dans le but de vous éclairer sur votre pathologie ou les techniques utilisées pour le traitement de celle-ci. Ces fiches complètent l’information orale reçue en consultation.
Les informations sur les techniques d’endoscopie ou de pneumologie peuvent être trouvées sur le site du département de pneumologie.
Pour toute information complémentaire sur les cancers du poumon, vous pouvez également consulter le site de l’Institut Curie
LES CENTRES EXPERTS DES DÉPARTEMENTS DE CHIRURGIE THORACIQUE
ET PNEUMOLOGIE
Le Centre d’Investigation des Tumeurs du Thorax (CITT) fait partie de l’Institut du Thorax et se situe sur le site Montsouris
Plus de 300 patients ont bénéficié du CITT dans l’année 2016
Son objectif : améliorer les délais de prise en charge diagnostique et thérapeutique des opacités tumorales découvertes sur une radiographie pulmonaire ou un scanner du thorax.
Le contact téléphonique : 01 56 61 61 00
Lors du contact téléphonique de prise de rendez-vous, le patient est orienté vers l’infirmière coordinatrice du CITT qui recueille les données relatives aux examens déjà réalisés. Elle organise une première consultation avec un pneumologue dans les jours qui suivent.
La Consultation d’accueil
Au cours de la première consultation, des orientations diagnostiques sont envisagées en fonction des antécédents du patient et des premiers examens disponibles. Les examens complémentaires nécessaires au bilan sont prescrits.
A l’issue de la consultation, l’infirmière coordinatrice reçoit le patient afin d’organiser sa prise en charge. Elle organise les rendez-vous d’examens complémentaires au sein de l’Institut du Thorax (site Montsouris et site Curie) ou à l’extérieur de Montsouris avec des centres de référence partenaires du CITT. Elle complète les informations concernant le déroulement des différents examens. Elle collige les résultats des examens réalisés et planifie la consultation de synthèse. Elle accompagne et assiste le patient dans ses démarches administratives.
Lors de la première consultation, le patient reçoit une pochette dans laquelle seront intégrés les explications relatives aux examens, une fiche récapitulant le planning des examens, horaires et lieux des rendez-vous, que ce soit au sein de l’Institut du Thorax ou à l’extérieur. Dans le cas d’un examen prescrit dans un autre établissement, les coordonnées et le plan d’accès sont fournis.
Le bilan
Certains des examens prescrits par le pneumologue seront planifiés au sein du plateau technique de l’Institut du Thorax :
- Sur le site Montsouris : fibroscopie bronchique, explorations fonctionnelles respiratoires, électrocardiogramme, bilan biologique, consultation d’anesthésie, imagerie cérébrale, ponction biopsie transpariétale sous scanner, écho-endoscopie bronchique, échographie cardiaque, échographie des troncs supra-aortiques, coronarographie…
- Sur le site Curie : ponction biopsie transpariétale sous scanner, TEP-18FDG ou scintigraphie pulmonaire
Si nécessaire, l’infirmière coordinatrice propose au patient de se rendre dans un établissement partenaire assurant les mêmes délais rapides de prise en charge et, dans la mesure du possible, proche de son domicile.
La Consultation de synthèse
A l’issue de l’ensemble des examens, un diagnostic est le plus souvent établi. Le patient est revu par le pneumologue pour une consultation de synthèse et est orienté au sein de l’Institut du Thorax soit vers le département Thoracique (Site Montsouris) pour une intervention chirurgicale, soit vers le service d’Oncologie (Site Curie) pour un traitement médical ou encore vers un autre établissement partenaire en fonction de la pathologie.
Contacts
- Infirmière coordinatrice : Isabelle Baumer
- Pneumologues du CITT : Dr Raffaele Caliandro, Dr Philippe Girard, Dr Jean-Baptiste Stern et Dr Thibault Vieira
- Téléphone : 01 56 61 61 00 / Fax : 01 56 61 62 32 / Courriel : citt@imm.fr.
Fiche mise à jour le 30 décembre 2016
Contact : 01 56 61 62 80
Présentation
Le Centre de Pneumologie Interventionnelle (CPI) de l’Institut Mutualiste Montsouris est composé d’une équipe de pneumologues formés aux techniques diagnostiques endoscopiques modernes, notamment celles utilisant l’échographie endo-bronchique. L’objectif de ces examens est d’améliorer la performance diagnostique des nodules pulmonaires ou des ganglions médiastinaux anormaux.
Le CPI prend également en charge en urgence les obstructions de la trachée et des grosses bronches, qu’elles soient d’origine tumorale ou causées par des corps étrangers. Cette prise en charge peut comporter la pose de prothèses ou stents endobronchiques.
Enfin, le CPI prend en charge les pathologies de la plèvre, en particulier les pleurésies, par la réalisation de biopsies pleurales, de ponctions diagnostiques et évacuatrices, de pose de drains thoraciques adaptés à l’étiologie de la pleurésie
Fonctionnement du CPI
Le contact téléphonique
Orienté par son médecin traitant, ou pouvant appeler de lui-même, le patient est en contact téléphonique avec l’infirmière ou la secrétaire coordinatrice du Centre de Pneumologie Interventionnelle. Celle-ci recueille les données relatives aux examens déjà réalisés, et oriente le/la patient(e) vers le médecin réalisant des examens complémentaires ou vers l’hospitalisation si nécessaire.
La consultation
Pour organiser et programmer ces examens spécialisés, le patient doit être vu en consultation par le pneumologue. Pour les examens nécessitant une anesthésie générale, un rendez vous avec l’anesthésiste suivra la consultation. Dans certains cas, une admission en urgence peut s’avérer nécessaire, sans passer par la consultation.
L’endoscopie spécialisée
La fibroscopie bronchique : réalisée sous anesthésie locale ou générale, elle permet de visualiser l’arbre bronchique proximal et de réaliser des prélèvements (biopsies, analyses microbiologiques). En cas de nodule pulmonaire périphérique, le plus souvent la fibroscopie ne permet pas le diagnostic, il faut donc avoir recours à d’autres examens, notamment l’écho-endoscopie bronchique radiale (mini-sonde).
L’écho-endoscopie bronchique radiale : cet examen réalisé sous AG en ambulatoire permet de biopsier des nodules ou masses pulmonaires qui ne sont pas accessibles par une fibroscopie bronchique « classique », car trop distaux dans l’arbre respiratoire.
L’écho-endoscopie bronchique linéaire (EBUS) avec ponction ganglionnaire : cet examen réalisé sous anesthésie générale en ambulatoire permet de biopsier des ganglions du médiastin (partie médiane du thorax) qui semblent pathologiques.
La bronchoscopie interventionnelle
Certaines pathologies de la trachée ou des grosses bronches nécessitent une désobstruction en urgence avec éventuellement la pose d’une prothèse. Dans ces cas, une hospitalisation en urgence peut être nécessaire.
Une fausse route par inhalation d’un corps étranger enclavé dans l’arbre bronchique peut également justifier d’une bronchoscopie rigide en urgence.
Les pathologies de la plèvre
Le CPI permet de prendre en charge en consultation ou en courte hospitalisation l’ensemble des maladies de la plèvre.
Réalisation de biopsies pleurales : elles sont parfois nécessaires pour déterminer la nature de la pleurésie. Cela peut être fait en consultation externe sous anesthésie locale, ou parfois au bloc opératoire par thoracoscopie sous anesthésie générale par un chirurgien thoracique.
Pose de drain tunnélisés PleurX® : en cas de pleurésie chronique ou rapidement récidivante, il est parfois nécessaire de poser un drain qui pourra être laissé en place plusieurs semaines si nécessaire. Ces drains sont posés sous anesthésie locale, habituellement lors d’une courte hospitalisation.
Rédacteurs: Dr JB. Stern – Dr R. Caliandro.
Fiche mise à jour le 2 mai 2016
PATHOLOGIE
 TELECHARGER LA FICHE
TELECHARGER LA FICHE  TELECHARGER LA FICHE
TELECHARGER LA FICHE  TELECHARGER LA FICHE
TELECHARGER LA FICHE  TELECHARGER LA FICHE
TELECHARGER LA FICHE  TELECHARGER LA FICHE
TELECHARGER LA FICHE  TELECHARGER LA FICHE
TELECHARGER LA FICHE
TECHNIQUES CHIRURGICALES
 TELECHARGER LA FICHE
TELECHARGER LA FICHE 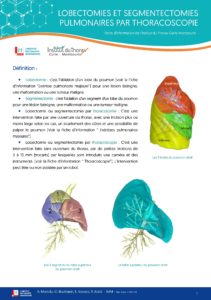 TELECHARGER LA FICHE
TELECHARGER LA FICHE  TELECHARGER LA FICHE
TELECHARGER LA FICHE  TELECHARGER LA FICHE ROBOT
TELECHARGER LA FICHE ROBOT  TELECHARGER LA FICHE
TELECHARGER LA FICHE 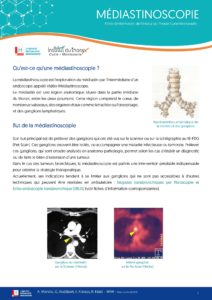 TELECHARGER LA FICHE
TELECHARGER LA FICHE TELECHARGER LA FICHE
TELECHARGER LA FICHE 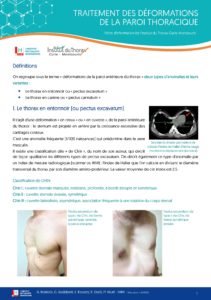 TELECHARGER LA FICHE
TELECHARGER LA FICHE TELECHARGER LA FICHE
TELECHARGER LA FICHE 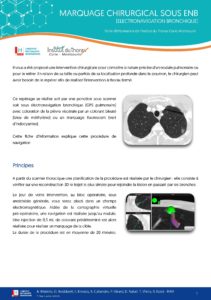 TELECHARGER LA FICHE MARQUAGE
TELECHARGER LA FICHE MARQUAGE
