Infos patients Cardiologie
Les spécialistes du département ont rédigé des fiches d’information dans le but de vous éclairer sur votre pathologie ou les techniques utilisées pour le traitement de celle-ci.
Ces fiches complètent l’information orale reçue en consultation.
Qu’est ce qu’une CARDIOPATHIE HYPERTROPHIQUE OBSTRUCTIVE (CMHO) ? :
Cette maladie d’origine génétique est responsable d’un épaississement de votre muscle cardiaque qui créée un obstacle à l’expulsion du sang vers vos organes.
Les conséquences de cette affection sont essentiellement de l’essoufflement à l’effort, des douleurs thoraciques à l’effort ou encore des malaises le plus souvent à l’effort.
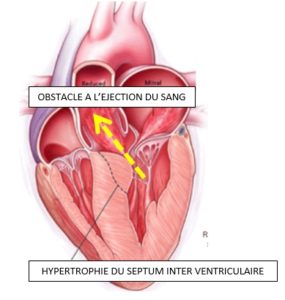
Quel est le traitement de la CMHO? :
Le traitement de cette maladie est toujours dans un premier temps médical. Lorsque le traitement médical maximum est insuffisant, et que l’essoufflement à l’effort gène notablement la vie courante, d’autres solutions sont envisageables.
Si la chirurgie cardiaque a été longtemps utilisée, l’alcoolisation septale se pose depuis une dizaine d’années comme une solution moins agressive pour diminuer la gêne à l’éjection du sang en réduisant l’épaisseur du muscle cardiaque, ce qui diminue l’essoufflement à l’effort.
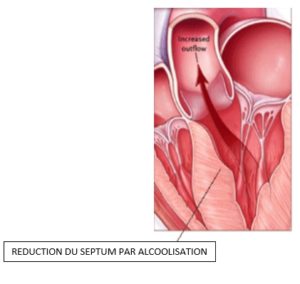
En quoi consiste la procédure d’alcoolisation septale? :
Le principe est de créer une zone d’infarctus du myocarde, à l’endroit jugé trop épais et responsable de l’obstacle à l’éjection du sang.
L’intervention est réalisée sous anesthésie locale, sédatifs et antalgiques, en présence d’une équipe d’anesthésie.
Un cathéter est introduit par l’artère fémorale (au pli de l’aine) ou radiale (au poignet). Par cette voie est mis en place un ballonnet gonflable au niveau d’une petite artère coronaire irriguant la zone musculaire du cœur trop épaisse. Un produit de contraste est d’abord injecté dans cette artère pour vérifier par échographie qu’elle vascularise bien la zone que l’on veut réduire. 1 à 3ml d’alcool pur est injecté en quelques minutes dans cette petite artère.
Ceci va entraîner un infarctus localisé qui va permettre de diminuer l’épaississement de votre muscle cardiaque et ainsi diminuer (parfois tout de suite, parfois après quelques jours ou semaines seulement) l’obstruction qui gène le fonctionnement de votre cœur et améliorer ainsi l’essoufflement à l’effort dont vous vous plaignez.
Un stimulateur cardiaque temporaire est laissé en place 48h (au pli de l’aine dans la veine fémorale remontant jusqu’à la partie droite du cœur).
Après votre examen, étant donné le risque d’anomalies de la conduction cardiaque pouvant nécessiter un stimulateur cardiaque définitif, vous serez admis dans le service de soins intensifs de cardiologie pendant au moins 72 heures puis surveillé en hospitalisation simple pendant quelques jours.
Qu’est ce que la communication inter auriculaire (CIA) ?
Les deux oreillettes sont séparées par une cloison nommée septum interauriculaire. Normalement, cette cloison est fermée à la naissance
Dans certains cas, il persiste une communication interauriculaire (CIA) dépistée dans l’enfance ou parfois à l’âge adulte. Cette CIA peut être responsable d’insuffisance cardiaque ou responsable d’accidents vasculaires.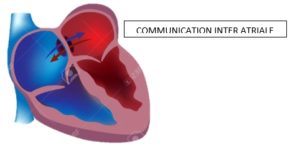 Quel est le traitement de la CIA ?
Quel est le traitement de la CIA ?
La CIA peut être fermée soit par voie chirurgicale soit par voie endo vasculaire non chirurgicale. L’indication est posée en fonction de votre cas particulier à l’issue d’un bilan d’imagerie (scanner cardiaque, échographie trans thoracique et trans oesophagienne).
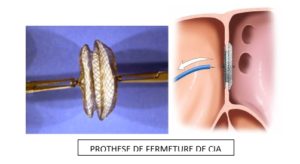
Comment se déroule une fermeture de CIA ?
La procédure consiste en l’implantation d’une prothèse comprenant 2 disques en grillage métallique (nitinol) reliés par un petit raccord et qui se positionnent de chaque côté de la cloison entre les 2 oreillettes pour la rendre étanche. Cette prothèse souple est implantée par cathétérisme cardiaque via une ponction de la veine fémorale, guidée par une échographie.
L’implantation est guidée par une échographie par voie trans oesophagienne nécessitant une anesthésie générale.
L’hospitalisation est courte, quelques heures à 24 heures après la procédure.
Qu’est ce qu’un foramen ovale perméable (FOP) ?
Le foramen ovale est un passage dans la cloison séparant les deux oreillettes du cœur présent au stade de la vie embryonnaire (il permet ainsi le passage du sang oxygéné du placenta vers les cavités gauches du cœur).
Il se ferme spontanément peu après la naissance. Il peut arriver que cette fermeture ne se fasse pas ou se ré-ouvre (on parle alors de foramen ovale « perméable »).
FICHE-INFO-SITE-CIA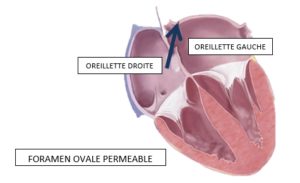 Pourquoi vous propose-t-on une fermeture de foramen ovale perméable ?
Pourquoi vous propose-t-on une fermeture de foramen ovale perméable ?
Le FOP peut être responsable de symptômes à l’âge adulte dont le plus grave est l’accident vasculaire cérébral. L’association à un anévrysme du septum inter atrial (ASIA) est parfois constatée, et augmente le risque de complications neurologiques.
La survenue de cette complication neurologique peut nécessiter la fermeture du foramen ovale perméable pour prévenir une récidive.
Réalisation d’une fermeture de foramen ovale perméable
La procédure consiste en l’implantation d’une prothèse comprenant 2 disques en grillage métallique (nitinol) reliés par un petit raccord et qui se positionnent de chaque côté de la cloison entre les 2 oreillettes pour la rendre étanche.
Cette prothèse souple est implantée par cathétérisme cardiaque via une ponction de la veine fémorale, guidée par échographie. L’implantation est guidée par échographique transoesophagienne nécessitant une anesthésie générale.
Qu’est ce qu’une fuite para prothétique mitrale ? :
Il s’agit d’une fuite située à côté de votre prothèse mitrale, et qui a pour conséquence un reflux du sang du ventricule gauche vers l’oreillette gauche.
La cause de cette fuite est une désinsertion, plus ou moins étendue, de la prothèse qui vous a été implantée par voie chirurgicale.
Cette désinsertion peut être d’origine infectieuse (endocardite) ou mécanique (fragilité du tissu, difficultés de suture en lien avec des calcifications présentes sur votre valve). Elle peut exister depuis la période post-opératoire ou apparaître secondairement.
Quelles sont les conséquences d’une fuite para prothétique mitrale ? :
La fuite a pour conséquence une augmentation du travail cardiaque et peut entraîner des symptômes en lien avec l’insuffisance cardiaque.
L’orifice de fuite peut également entraîner des anomalies des globules rouges (hémolyse) et donc une anémie.
Quels sont les trainements possibles d’une fuite para prothétique mitrale ? :
Toutes les fuites para prothétiques n’indiquent pas d’intervention. Une intervention vous a été proposée si votre fuite a été jugée importante, responsable de symptômes.
Le traitement de référence est chirurgical.
Dans certains cas, la chirurgie a été considérée comme risquée par une équipe multidisciplinaire (risques liés à une ré intervention ou risque de récidive), et il peut être proposé une occlusion de l’orifice de fuite par voie percutanée.
La faisabilité de la procédure est évaluée par une équipe pluridisciplinaire, grâce à des examens d’imagerie (échographie trans-œsophagienne (ETO) et scanner cardiaque). Ces examens permettent de planifier la procédure (taille du dispositif d’occlusion à choisir, éventuelles difficultés anatomiques).
Comment se déroule l’intervention de fermeture par voie per cutanée ? :
La procédure sera réalisée sous anesthésie générale par une équipe de médecins formés à la technique.
L’équipe est composée d’un anesthésiste et d’un infirmier anesthésiste, de deux cardiologues interventionnels, d’un échographiste interventionnel et d’infirmières de cathétérisme. Compte-tenu de la technicité de la procédure, un ingénieur technique mandaté par le laboratoire distribuant le dispositif pourra être présent lors de votre intervention. La procédure est guidée par ETO.
Un traitement anticoagulant par héparine est administré en début de procédure et renouvelé si nécessaire pendant l’intervention.
Un guide est introduit en passant par votre veine fémorale. Il est monté ensuite jusqu’à votre oreillette droite. Un cathéter est ensuite inséré grâce au guide. L’opérateur réalise une ponction trans septale qui permet de passer de l’oreillette droite à l’oreillette gauche, sous guidage ETO.
Ensuite, différents cathéters peuvent être utilisés pour atteindre l’orifice et le traverser. On introduit et on déploie ensuite le dispositif d’occlusion dont la forme et la taille ont été précédemment choisies grâce à l’évaluation échographique. Un ou plusieurs dispositifs peuvent être nécessaires.
La procédure dure entre 1 h 30 et 4 h.
Vous serez hospitalisé(e) pour une durée moyenne de 5 à 7 jours liée essentiellement à la gestion de votre traitement anticoagulant en péri opératoire.
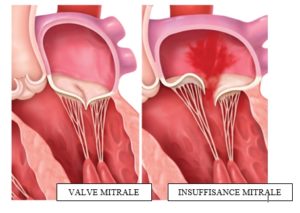
Qu’est ce qu’une fuite mitrale ? :
La valve mitrale est un petit « clapet » séparant l’oreillette gauche du ventricule gauche. Cette valve s’ouvre pour laisser passer le sang et remplir le ventricule gauche et se ferme au moment de l’éjection du ventricule gauche vers l’aorte. À l’état normal, elle est totalement continente et ne laisse pas passer de sang vers l’oreillette gauche lorsqu’elle est fermée.
L’insuffisance mitrale (ou fuite mitrale) est un défaut de fermeture des deux feuillets de la valve, entrainant un reflux de sang anormal du ventricule gauche dans l’oreillette gauche pendant la phase d’expulsion du sang (systole).
Ce reflux entraîne une diminution du débit cardiaque, et une augmentation de pression dans l’oreillette gauche puis dans les poumons aboutissant à terme à des symptômes d’insuffisance cardiaque (essoufflement, fatigue, œdème).
 Quel est le traitement de l’insuffisance mitrale ? :
Quel est le traitement de l’insuffisance mitrale ? :
Le traitement des insuffisances mitrales consiste à réparer (plastie) ou à remplacer la valve mitrale (prothèse) afin de corriger la fuite au cours d’une chirurgie cardiaque à cœur ouvert.
Pour certains patients, une chirurgie à cœur ouvert peut s’avérer à risque élevé.
Ce risque est évalué par une équipe médicale multidisciplinaire (cardiologues interventionnels, cardiologues cliniciens, cardiologues échographistes, chirurgiens cardiaques, anesthésistes et réanimateurs, gériatre ou médecin interniste), qui fait la synthèse de l’ensemble des antécédents du patient, et de son état général.
Dans quel cas proposer une correction par voie percutanée ?
Un système de réparation de la valve mitrale par voie percutanée, passant par la
veine fémorale, (système MITRACLIP®), disponible en Europe depuis 2008, peut être proposé pour certains patients pour lesquels une chirurgie conventionnelle a été jugée risquée.
La mise en place du dispositif ne nécessite pas d’ouverture chirurgicale du thorax.
Des critères techniques de faisabilité doivent par ailleurs être remplis pour bénéficier de cette technique (évaluation préalable par échographie Trans thoracique et Trans œsophagienne, par un médecin expert).
Comment se déroule l’intervention de fermeture par voie per cutanée ? :
La procédure de pose du système est réalisée sous anesthésie générale par une équipe de médecins experts (cardiologues interventionnels).
Le système MITRACLIP® est introduit en passant par la veine fémorale en utilisant un cathéter (tuyau), amené jusqu’à la valve mitrale en passant entre l’oreillette droite et l’oreillette gauche.
Le système est ensuite attaché directement à la valve mitrale sous guidage échographique (Trans-œsophagien).
La mise en place de ce dispositif est réalisée grâce à un dispositif de fixation manipulable depuis l’extérieur du patient qui permet de positionner le clip avec précision. Ce système va attacher les deux feuillets de la valve mitrale pour réduire l’insuffisance mitrale.
L’hospitalisation pour la procédure est courte (3 jours en moyenne, variable selon votre cas précis et le type de fuite mitrale prise en charge). Il n’y a pas de réadaptation nécessaire à l’issue.
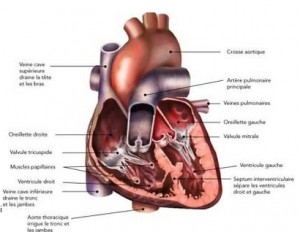 Le cœur est logé dans le thorax. Il est presque médian. Sa pointe est orientée vers le côte gauche et vers l’avant. De chaque côté, la région du cœur est occupée par les poumons.
Le cœur est logé dans le thorax. Il est presque médian. Sa pointe est orientée vers le côte gauche et vers l’avant. De chaque côté, la région du cœur est occupée par les poumons.
Le cœur est composé de 4 cavités :
- L’oreillette droite reçoit des veines caves supérieure et inférieure le sang veineux périphérique, qui se jette au travers de la valve tricuspide dans :
- Le ventricule droit qui en se contractant chasse le sang dans l’artère pulmonaire. L’artère pulmonaire est pourvue d’un clapet à trois valvules sigmoïdes dite valve pulmonaire. Le ventricule droit chasse le sang vers les poumon où il s’oxygènera. Le sang oxygéné retourne vers :
- L’oreillette gauche par les 4 veines pulmonaires ; se jette ensuite au travers de la valve mitrale
- Le ventricule gauche qui en se contractant chasse le sang dans l’aorte ; est aussi pourvu d’un système anti-reflux fait de trois valvules dit valve aortique.
Le cœur est une pompe musculaire qui pour fonctionner doit s’approvisionner en oxygène et en éléments nutritifs, qu’il reçoit des artères coronaires.
Les artères coronaires
Les artères coronaires naissent de la base de l’aorte au niveau d’orifices appelés ostia. Ils sont au nombre de deux :
- Artère coronaire gauche : c’est la plus importante des deux coronaires naissant de la face antéro-gauche de l’aorte au-dessus de la valve aortique. Ce tronc coronaire gauche mesure entre 0,5 et 2 cm, il se divise ensuite en deux branches principales : l’artère interventriculaire antérieure et l’artère circonflexe.
- L’artère coronaire droite : elle prend naissance sur la partie antéro-droite de l’aorte au-dessus de la valve aortique. Elle donne de nombreuses branches collatérales. Dans son segment terminal, la coronaire droite se divise en artère rétroventriculaire et en artère intraventriculaire postérieure.
L’aorte
Elle est divisée anatomiquement en deux parties : l’aorte thoracique et l’aorte abdominale.
L’aorte thoracique est divisée en :
- L’aorte ascendante, qui constitue le segment initial de l’aorte. Elle émerge du ventricule gauche, dont elle est séparée par la valve aortique. Les artères coronaires naissent de cette portion.
- L’aorte horizontale ou crosse aortique, trois vaisseaux naissent de cette crosse aortique, et irriguent la tête et les bras.
- L’aorte descendante.
L’échocardiographie doppler est un examen non invasif dont le principe est fondé sur
l’analyse des signaux ultrasonores émis puis recueillis par une sonde posée sur le thorax
en regard du coeur.
Cet examen permet d’obtenir de très nombreux renseignements sur la morphologie et la
fonction des différentes structures composant le coeur (valves, myocarde, endocarde,
péricarde) et des gros vaisseaux (aorte, artère pulmonaire, veines caves…). Il permet
également en analysant la morphologie, la direction, et la vélocité des flux sanguins à
l’intérieur des cavités cardiaques et à travers les valves de déceler des flux anormaux
(fuites ou sténoses valvulaires par exemple) et d’apprécier l’importance, ainsi que
d’obtenir des renseignements hémodynamiques importants (mesure de pressions
pulmonaires, calcul du débit cardiaque, étude de la fonction systolique globale…).
La multiplicité des renseignements ainsi obtenus et leur caractère quantitatif, joints au
caractère non invasif de l’examen ont fait de l’échographie doppler un outil indispensable
et d’usage quasi-systématique dans la grande majorité des pathologies cardiaques.
L’Echocardiographie trans-oesophagienne
Le développement de l’endoscopie digestive a permis la mise au point de sondes
d’échographies trans-oesophagiennes, qui permettent l’étude du massif cardiaque par
voie postérieure, au travers de la paroi oesophagienne située au contact de l’oreillette
gauche. Cet examen est d’utilité incontestable dans l’étude de structures situées en
profondeur dans le thorax et souvent peu ou mal visualisables par voie trans-thoracique
(analyse des oreillettes, des prothèses valvulaires, recherche d’endocardite, étude de
l’aorte thoracique…). Cet examen de durée brève ne nécessite généralement pas
d’anesthésie générale, et se fait après anesthésie locale de la gorge chez un patient à
jeun. Bien qu’inconfortable, il est dans la quasi-totalité des cas parfaitement supporté.
L’échographie de Stress
La perfusion intraveineuse d’agents pharmacologiques, capables d’augmenter la
contractilité et la fréquence cardiaque (comme la dobutamine) permet l’étude précise de
la contractilité des différents segments myocardiques sous l’effet de cette stimulation :
c’est le principe de l’échographie de stress. Cet examen trouve ses applications dans la
détection et l’étude de l’insuffisance coronarienne. Il peut être utilisé lorsque l’ECG d’effort
est d’interprétation difficile, ou pour préciser l’étendue et la localisation des territoires
ischémiques chez des patients ayant une probabilité importante d’être coronarien, ou
pour apprécier le caractère fonctionnel d’une sténose coronaire. Il peut également après
un infarctus du myocarde être très utile pour rechercher une ischémie résiduelle ou une
sidération myocardique, ou bien rechercher une viabilité myocardique pouvant justifier
une revascularisation dans les dysfonctions ventriculaires gauches ischémiques
chroniques. Il permet également d’évaluer l’état coronarien avant une intervention
chirurgicale sur un terrain à risque.
Pourquoi vous propose-t-on une coronarographie ?
La coronarographie est l’examen qui permet de faire une radiographie filmée de vos
artères coronaires possiblement responsables de ce que vous ressentez
actuellement ou de ce que votre cardiologue a décelé. Cet examen comprend
également une séquence évaluant le fonctionnement du ventricule gauche (muscle
cardiaque qui pompe le sang pour l’ensemble de l’organisme). La coronarographie
permet de déceler un ou plusieurs rétrécissements à l’origine des douleurs ou d’un
infarctus. Elle permet de faire le meilleur choix de traitement :
- par des médicaments
- par angioplastie coronaire (dilatation)
- par pontage coronaire chirurgical
La coronarographie comporte-t-elle des risques ?
Malgré les progrès et les précautions prises, cet examen peut comporter un risque
d’incidents ou d’accidents :
- des risques allergiques liées à l’utilisation des produits radiologiques iodés ou d’anesthésie locale. Si vous avez déjà présenté des manifestations allergiques, il faut en informer le médecin ;
- des risques locaux au niveau du point de ponction favorisés par l’utilisation des traitements anticoagulants. Le plus souvent il s’agit d’un hématome parfois douloureux, qui peut persister plusieurs jours, mais qui est habituellement sans conséquence. Exceptionnellement, une réparation chirurgicale peut être nécessaire.
- des risques cardiaques : au décours peuvent survenir des douleurs dans la poitrine, des palpitations liées à un trouble du rythme. La mobilisation d’un caillot, la blessure d’une artère ou une autre complication peuvent conduire à une nouvelle angioplastie ou un pontage coronaire en urgence. Il existe aussi un risque d’infarctus du myocarde, d’embolies ou de décès (1/10.000).
- Resténose : au niveau des zones dilatées, va se produire une cicatrisation qui peut être à l’origine d’une récidive de la sténose (resténose), en général dans les 6 premiers mois. Une nouvelle dilatation est parfois possible.
Quels bénéfices attendre de la coronarographie ?
La coronarographie est le seul examen pour prendre la décision thérapeutique
appropriée à votre état et qui sera prise avec votre accord.
Quelques conseils :
L’hospitalisation pour une coronarographie se fait en général la veille de l’intervention
pour permettre un bilan : examen clinique, bilan sanguin, radiographie thoracique,
électrocardiogramme.
L’exploration dure environ 1 heure. Le résultat de l’examen vous sera communiqué
par le médecin. La sortie est autorisée le lendemain ou surlendemain si une
angioplastie coronaire a été effectuée.
Voici quelques recommandations médicales auxquelles nous vous demandons de
bien vouloir prêter attention :
– Si le traitement que vous prenez quotidiennement comprend de l’aspirine,
vous pouvez poursuivre ce médicament même le jour de votre hospitalisation.
– Si vous êtes sous traitement anti-coagulant (Sintrom, Préviscan, Coumadine),
téléphonez à votre cardiologue ou dans le département de Pathologie cardiaque
(01.56.61.65.07) afin qu’un cardiologue vous conseille.
Enfin, pensez à apporter avec vous lors de votre hospitalisation tous les documents
même anciens en votre possession pouvant avoir un rapport avec votre maladie
(E.C.G., échocardiogramme, radios, carte de groupe sanguin, examens biologiques,
comptes-rendus médicaux, films de coronarographie) ainsi que votre carnet de
santé.
Reportage vidéo
Explications avec les cardiologues du département de cardiologie interventionnelle de l’Institut Mutualiste Montsouris.
Quelques conseils :
L’hospitalisation pour un Cathétérisme cardiaque se fait en général la veille de
l’intervention pour permettre un bilan : examen clinique, bilan sanguin, radiographie
thoracique, électrocardiogramme.
L’exploration dure environ 1 à 2 heures. Le résultat de l’examen vous sera
communiqué par le médecin. La sortie est autorisée le lendemain ou surlendemain si
une angioplastie coronaire a été effectuée.
Voici quelques recommandations médicales auxquelles nous vous demandons de
bien vouloir prêter attention :
– Si le traitement que vous prenez quotidiennement comprend de l’aspirine,
vous pouvez poursuivre ce médicament même le jour de votre hospitalisation.
– Si vous êtes sous traitement anti-coagulant (Sintrom, Préviscan, Coumadine),
téléphonez à votre cardiologue ou dans le département de Pathologie cardiaque
(01.56.61.65.07) afin qu’un cardiologue vous conseille.
Enfin, pensez à apporter avec vous lors de votre hospitalisation tous les documents
même anciens en votre possession pouvant avoir un rapport avec votre maladie
(E.C.G., échocardiogramme, radios, carte de groupe sanguin, examens biologiques,
comptes-rendus médicaux, films de coronarographie) ainsi que votre carnet de
santé.
Qu’est ce qu’une salle hybride ?
Une salle hybride associe les qualités d’une salle d’opération et d’une salle de radiologie. Elle permet aux médecins de réaliser en un seul temps des traitements combinés et multiples sur le même patient. Cette salle qui est classée ISO 5 est la norme recommandée au bloc opératoire. Elle est obtenue à l’aide d’un flux unidirectionnel à haut volume. Elle est équipée d’une table d’opération mais également d’un arceau de radiologie. La même table peut servir en même temps de table de radiologie ou de table d’opération en fonction de l’intervention programmée. Un pupitre de commande centralisé permet de contrôler la gestion des flux d’images et des dispositifs médicaux. Elle est également équipée d’un système de visioconférence.
Pourquoi une salle hybride ?
La cardiologie interventionnelle et la chirurgie cardiaque permettent toutes deux de traiter et de réparer le cœur. Traditionnellement la chirurgie se fait au travers d’incisions alors que l’angioplastie est pratiquée en passant par les artères ou les veines sans effectuer d’incisions.
De nouvelles techniques associant les techniques de chirurgie cardiaque conventionnelle aux techniques de cardiologie et radiologie interventionnelle sont apparues grâces à la miniaturisation des instruments.
Il est par exemple possible de pratiquer un ou deux pontages coronaires par voie vidéoscopique et de pratiquer la pose d’un stent sur une autre artère coronaire chez le même patient au cours de la même intervention. Cela revient à pratiquer un triple pontage mais sans les inconvénients liés à l’ouverture et au stress opératoire.
D’autres techniques moins traumatisantes existent permettant de placer des valves aortiques par voie transfémorale, ou par de petites incisions cutanées (mini-incision thoracique) sous contrôle des rayons X et de l’échographie. Cette technique permet de traiter des patients à haut risque opératoire ou considérés comme inopérables par voie chirurgicale classique.
D’autres pathologies comme les anévrysmes ou les dissections de l’aorte thoracique ou abdominale peuvent être traitées par des prothèses endovasculaires.
Enfin certaines opérations sont possibles pour traiter l’arythmie cardiaque (fibrillation auriculaire) associant une approche vidéoscopique à une approche transfémorale afin de restaurer un rythme sinusal régulier.
Toutes ces interventions nécessitent une salle hybride qui permet une excellente visualisation radiologique et une sécurité opératoire indispensable. Cela permet de réaliser ou de développer des techniques innovantes rendant possible des interventions par des équipes de chirurgiens et médecins, tout en facilitant le geste de l’un ou de l’autre.
Pourquoi vous propose-t-on une angioplastie coronaire ?
L’angioplastie coronaire est une méthode de revascularisation myocardique qui offre,
lorsqu’elle est fiable, la possibilité de dilater les artères rétrécies. Elle consiste à
mettre en place à l’endroit rétréci un ballonnet qui est gonflé pour dilater l’artère puis
dégonflé et retiré. Dans certains cas, une endoprothèse (stent) doit être mise en
place (tuteur rigide conservant l’effet obtenu par la dilatation).
L’angioplastie comporte-t-elle des risques ?
Malgré les progrès et les précautions prises, cet examen peut comporter un risque
d’incidents ou d’accidents :
- des risques allergiques liées à l’utilisation des produits radiologiques iodés ou d’anesthésie locale. Si vous avez déjà présenté des manifestations allergiques, il faut en informer le médecin ;
- des risques locaux au niveau du point de ponction favorisés par l’utilisation des traitements anticoagulants. Le plus souvent il s’agit d’un hématome parfois douloureux, qui peut persister plusieurs jours, mais qui est habituellement sans conséquence. Exceptionnellement, une réparation chirurgicale peut être nécessaire.
- des risques cardiaques : au décours peuvent survenir des douleurs dans la poitrine, des palpitations liées à un trouble du rythme. La mobilisation d’un caillot, la blessure d’une artère ou une autre complication peuvent conduire à une nouvelle angioplastie ou un pontage coronaire en urgence. Il existe aussi un risque d’infarctus du myocarde, d’embolies ou de décès (1/10.000). L’angioplastie peut échouer car le rétrécissement ou l’occlusion peuvent être impossible à franchir ou à dilater et la mise en place d’un stent n’est plus toujours possible.
- Resténose : au niveau des zones dilatées, va se produire une cicatrisation qui peut être à l’origine d’une récidive de la sténose (resténose), en général dans les 6 premiers mois. Une nouvelle dilatation est parfois possible.
Les bénéfices attendus par l’angioplastie coronaire
En permettant un apport de sang plus important, elle augmente la vascularisation du
myocarde et réduit ou fait disparaître l’angine de poitrine et améliore l’évolution à
long terme.
L’échocardiographie de stress consiste à enregistrer des séquences d’échocardiographie par voie transthoracique (voir fiche « Echographie transthoracique ») au cours d’un effort ou pendant la perfusion d’un médicament qui accélère le cœur : la Dobutamine. Cette technique validée depuis le début des années 1990 est non irradiante (à l’opposé de la scintigraphie cardiaque) et facilement disponible.
L’échographie d’effort permet d’analyser le fonctionnement cardiaque dans des conditions de stress « naturel » (ou physiologique).
L’échographie sous perfusion de Dobutamine (qui accélère le cœur sans véritable effort) est réservée aux patients incapables de fournir un effort physique suffisant (problèmes orthopédiques, maladie respiratoire, etc.).
L’échocardiographie de stress ne peut être réalisée que dans un environnement hospitalier, avec un personnel médical et paramédical expert dans ce type de procédures ; elle se déroule sous la surveillance constante des paramètres cardiaques et respiratoires : ECG, pression artérielle, fréquence respiratoire.
L’analyse précise de la contraction segmentaire du ventricule gauche lors des différentes étapes du stress est possible grâce à la numérisation des images d’échographie par un logiciel intégré qui permet une analyse « Off-line ».
Echocardiographie d’effort
Principe/ Déroulement de l’examen
L’échographie d’effort est réalisée sur une table d’examen spéciale (Figure) multi-réglable, munie d’un pédalier. Cet examen est réalisé par un binôme : Cardiologue + Infirmière.
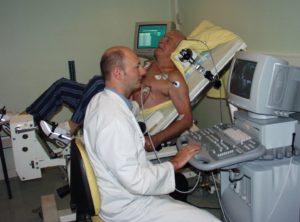
Echographie d’effort réalisée sur une table ergométrique.
Quatre à cinq séquences d’échographie cardiaque (clips vidéo) standardisées sont enregistrées au repos. Puis le patient pédale en position assise et le cardiologue enregistre les mêmes séquences d’échographie tout au long de l’effort puis en récupération. L’ECG, la pression artérielle et la fréquence cardiaque sont surveillés en continu par l’infirmière pendant tout l’examen.
Pour chaque patient, le protocole d’effort est adapté « sur mesure » avec une augmentation progressive de la charge, le plus souvent par palier de 2 minutes, en essayant d’accélérer la fréquence cardiaque jusqu’à 85% de la fréquence maximale théorique (calculée selon la formule : 220 moins l’âge du patient).
L’échographie d’effort permet d’ajouter une technique d’imagerie cardiaque au test d’effort simple (ECG d’effort), ce qui améliore la précision de cet examen et permet de localiser les anomalies cardiaques (différentes parois du ventricule gauche), ce que l’ECG d’effort ne permet pas.
Principales indications
- L’échographie d’effort est essentiellement indiquée pour le diagnostic et la localisation d’éventuelles sténoses coronaires, ou en cas de suspicion de resténose coronaire après une angioplastie.
- Une indication moins fréquente est l’adaptation cardiaque à l’effort en cas de maladie valvulaire asymptomatique ou de symptômes équivoques. L’échographie d’effort peut permettre de mieux comprendre les symptômes du patient, de les rattacher à la valvulopathie et de dépister les « faux » asymptomatiques.
Echocardiographie sous Dobutamine
Principe/ Déroulement de l’examen
L’échographie-Dobutamine consiste à enregistrer des séquences d’échographie transthoracique au repos et à répéter cet enregistrement sur les mêmes « vues » toutes les 2 à 3 minutes sous perfusion de doses croissantes de Dobutamine.
La Dobutamine est un médicament qui stimule l’activité cardiaque : elle augmente la contractilité du muscle cardiaque dans un premier temps puis, à fortes doses entraîne une accélération de la fréquence cardiaque qui « mime » une épreuve d’effort.
L’intérêt est d’évaluer la fonction cardiaque lors d’un stress chez un patient qui ne peut pas fournir d’effort, ou chez qui l’effort est contrindiqué. Une injection d’Atropine est souvent réalisée en cours d’examen pour permettre d’écourter l’examen et d’en améliorer la sécurité et le confort du patient. En fin d’examen, un médicament « ralentisseur cardiaque » (généralement un bêtabloquant) est injecté dans la perfusion pour ramener au plus vite la fréquence cardiaque de repos.
Principales indications
- L’échographie-Dobutamine est indiquée pour le diagnostic et la localisation d’éventuelles sténoses coronaires lorsque l’effort est impossible.
- En cas de dysfonction cardiaque, après un infarctus du myocarde ou comme conséquence d’une maladie valvulaire évoluée, l’échographie Dobutamine permet d’évaluer la réserve de contractilité du myocarde (viabilité myocardique) afin de guider la prise en charge thérapeutique.
Contrindications à l’échographie de stress
L’échographie de stress est contrindiquée chez les patients dont la conditions cardiaque est instable : infarctus récent, douleurs cardiaques d’aggravation récente avec douleurs de repos, insuffisance cardiaque décompensée, troubles du rythme cardiaque. Certaines contrindications sont propres à l’injection d’Atropine (adénome prostatique, glaucome aigu) ou de bêtabloquant (asthme).
L’échocardiographie transthoracique (ETT) est l’échographie-Doppler cardiaque «standard», par opposition à des examens plus complexes tels que l’échographie transœsophagienne (ETO) ou l’échographie de stress (échographie d’effort/ Echographie Dobutamine).
L’échographie est une technique d’imagerie médicale employant les ultrasons pour étudier de façon non invasive les différentes structures qui constituent le cœur: le muscle cardiaque (myocarde), les valves cardiaques, l’enveloppe entourant le cœur (péricarde), et les gros vaisseaux qui partent du cœur (aorte et artère pulmonaire) ou qui y arrivent (veines caves et veines pulmonaires).
Les différentes modalité de Doppler permettent d’étudier dans le même temps les flux sanguins à l’intérieur des cavités cardiaques et des gros vaisseaux : c’est pourquoi on emploie le terme d’échographie Doppler cardiaque (Figure 1).
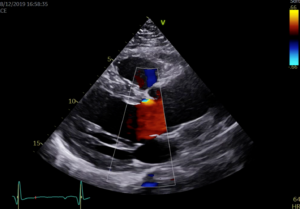
Figure 1 : Echographie cardiaque bidimensionnelle avec Doppler couleur. Le flux d’éjection du ventricule gauche (VG) à travers la valve aortique (en rouge) est superposé à l’imagerie des structures cardiaques.
Déroulement de l’examen
- Le patient est torse nu, allongé sur le lit d’examen, tourné sur son côté gauche. Cette position permet une meilleure qualité d’image échographique.
- On place 3 électrodes autocollantes sur le thorax, afin d’enregistrer l’ECG en même temps que l’échocardiographie.
- Le cardiologue pose la sonde dont l’extrémité est recouverte d’un gel (pour une meilleure transmission des ultrasons) sur le thorax à différents endroits (fenêtres ultrasonores, le plus souvent situées entre 2 côtes) pour visualiser les structures cardiaques sous différents angles.
- L’examen dure de 10 à 20 minutes. Il n’y a pas besoin d’être à jeûn. Il n’y a en général pas besoin de perfusion pour une échographie transthoracique
- Une fois l’examen terminé, le compte-rendu est rédigé « en direct » et remis au patient immédiatement.
Principales indications de l’ETT
L’échographie trans-thoracique donne des renseignements précis sur :
- Les 4 cavités cardiaques : ventricules gauche et droit, oreillettes correspondantes. On mesure les diamètres, calcule le volume des cavités ; on mesure également l’épaisseur des parois des parois du ventricule gauche et on quantifie la fonction ventriculaire par la fraction d’éjection (pourcentage de sang éjecté à chaque battement : valeurs normales entre 50 et 65%).
- L’état des valves cardiaques: épaisseur des valves, présence de calcification, rétrécissement de l’orifice valvulaire ou régurgitation (fuite) valvulaire. L’écho Doppler cardiaque est la méthode de référence pour une quantification précise du degré d’atteinte valvulaire.
- Le débit cardiaque est mesuré de façon fiable et rapide
- L’enveloppe cardiaque (péricarde) est également analysée de manière précise : présence d’un excès de liquide (épanchement péricardique), épaississement ou calcification péricardique.
Echographie bidimensionnelle (2D)
- Les ultrasons émis par la sonde d’échographie traversent facilement la peau, les muscles et les vaisseaux, ils sont arrêtés par l’air et l’os. Chaque structure traversée entraîne une réflexion partielle des ultrasons qui sont renvoyés vers la sonde.
- La distance des structures cardiaques par rapport à la sonde est calculée en fonction du temps écoulé entre l’émission et la réception. L’échographe reconstruit les images en 2 dimensions.
- L’imagerie bidimensionnelle permet de visualiser le muscle cardiaque, les valves, le péricarde et les gros vaisseaux en temps réel.
Imagerie Temps/ Mouvement (TM)
Le TM consiste à enregistrer le mouvement des structures cardiaques sur une « ligne de tir », en fonction du temps. La ligne de tir TM est positionnée à partir de l’imagerie bidimensionnelle. On obtient un tracé qui permet de mesurer de façon précise l’épaisseur du myocarde et le diamètre des cavités cardiaques.
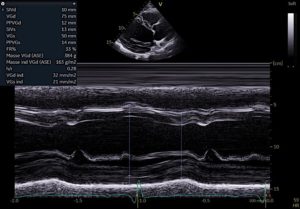
Figure 2: Echographie TM: mesure des diamètres ventriculaires gauche : diamètre maximal (remplissage, flèche jaune) et minimal (éjection, flèche rouge).
Echographie Tridimensionnelle (3D)
On dispose désormais de machines d’échographies et de sondes permettant d’acquérir une image tridimensionnelle du cœur en temps réel, ce qui permet une meilleure visualisation des structures cardiaques, notamment les valves cardiaques.
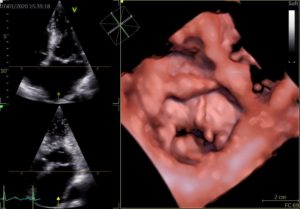
Figure 3 : Visualisation de la valve mitrale (VM) en échocardiographie 3D, la valve mitrale correspond à la zone délimitée par le pointillé ; la flèche blanche correspond à un prolapsus valvulaire mitral qui entraîne une perte d’étanchéité valvulaire (flèches roses) et une insuffisance mitrale.
L’échographie 3D permet une quantification plus précise des volumes cardiaques, notamment du ventricule gauche. Il faut une excellente qualité d’imagerie (bonne échogénicité) pour pouvoir utiliser l’imagerie 3D en échographie transthoracique.
Effet Doppler
- Le Doppler permet de calculer la vitesse du flux sanguin à travers un orifice valvulaire. D’après les vitesses, on déduit les différences de pression (gradients de pression) de part et d’autre de l’orifice, et on calcule la surface de l’orifice valvulaire.
- Le Doppler-couleur visualise en temps réel les flux sanguins à l’intérieur des cavités cardiaques. La couleur se superpose à l’image des parois et des valves cardiaques en noir et blanc. On détecte ainsi facilement une fuite valvulaire, qui apparaît comme un jet traversant une valve, à un moment où elle devrait être étanche.
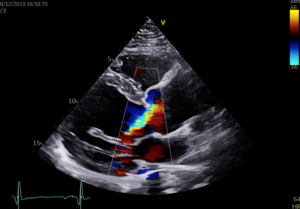
Figure 4: Echographie cardiaque bidimensionnelle avec Doppler couleur. Le jet d’insuffisance aortique (flèches) régurgitant dans le ventricule gauche (VG) est superposé à l’imagerie des structures cardiaques.
Principe de l’examen
L’échographie transœsophagienne (ETO) consiste à introduire par la bouche une sonde d’échographie miniaturisée, fixée à l’extrémité d’un fibroscope, comme on le fait pour une fibroscopie de l’estomac.
L’ETO est un examen potentiellement désagréable et pour cette raison, nous proposons systématiquement à l’IMM de le réaliser sous une courte anesthésie générale (AG) en ambulatoire. Cette courte AG nécessite une consultation d’anesthésie préalable à l’ETO.
L’œsophage passe entre l’oreillette gauche (en avant) et l’aorte thoracique (en arrière) ; ces structures cardiaques et vasculaires « profondes » sont donc très bien vues en ETO, leur proximité et l’absence d’interposition permettant d’utiliser des sondes de haute fréquence (de 5 à 7 MHz) dont la qualité d’imagerie (résolution spatiale) est nettement plus fine que celle des sondes d’échographie trans-thoraciques (ETT).
Comme pour l’ETT, les différentes modalités d’imagerie sont disponibles en ETO : imagerie bidimensionnelle (2D, Figure 1) avec superposition du Doppler couleur (Figure 2) et imagerie tridimensionnelle (3D-temps réel, Figure 3).
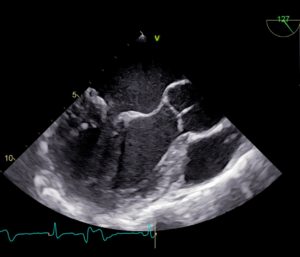
Figure 1: ETO/ image bidimensionnelle. OG = oreillette gauche ; VG = ventricule gauche
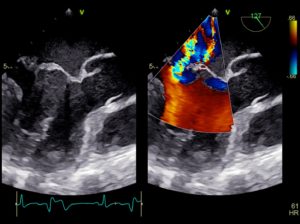
Figure 2: ETO/ image bidimensionnelle (A) et Doppler couleur (B). OG = oreillette gauche ; VG = ventricule gauche. Noter le jet d’insuffisance mitrale régurgitant dans l’OG (flèches)
Déroulement de l’examen
L’examen se déroule salle de réveil, en présence d’un anesthésiste, d’un infirmier anesthésiste et du cardiologue. La sonde d’échographie œsophagienne est décontaminée/ désinfectée, rincée et séchée après chaque examen. Pour l’ETO, on utilise un cale-dent à usage unique et la sonde œsophagienne est recouverte par une protection stérile à usage unique également.
Préparation du patient
On vérifie que le patient est bien à jeun depuis au moins 4 heures, qu’il (elle) n’a jamais eu de problème particulier à l’œsophage (diverticule, sténose oesophagienne), ni de problème de déglutition. Après vérification de la Check List et réassurance du patient, il est endormi par l’Anesthésiste (hypnotique administré par perfusion).
Temps d’examen
Une fois le patient endormi, le médecin introduit la sonde avec précaution et procède à l’examen qui dure généralement de 5 à 10 mn. De nombreuses images et clips vidéo sont stockées sur le disque dur de l’échographe et envoyées sur le réseau de l’hôpital pour analyse ultérieure, rédaction du compte-rendu et discussion collégiale du dossier du patient lors des staffs.
Après l’ETO
Le patient est réveillé rapidement (anesthésie peu profonde). Il est ensuite surveillé pendant le temps nécessaire en salle de réveil (de 30 à 60 minutes généralement). Le patient remonte ensuite en Hôpital de jour (secteur ambulatoire) où son résultat d’examen lui sera expliqué par le médecin et son compte rendu lui sera remis. Le retour à domicile, accompagné par un proche, est généralement possible 2 à 3 heures après l’examen, en fonction de l’organisation du jour.
Principales indications
- Description précise des valves cardiaques, notamment en prévision d’une chirurgie de réparation valvulaire ou d’un cathétérisme interventionnel (clip mitral).
- Visualisation d’une prothèse valvulaire mitrale ou aortique
- Visualisation précise des oreillettes et des auricules, notamment à la recherche d’un thrombus intra-cardiaque, dans le cadre d’un bilan d’accident vasculaire cérébral (AVC)
- Pathologie de l’aorte thoracique : plaques d’athérosclérose, hématome pariétal ou dissection aortique (contexte d’urgence).
- Analyse des veines caves, des artères pulmonaires
Contrindications
L’ETO est contre-indiquée en cas de pathologie de l’œsophage:
- Varices œsophagiennes, à cause du risque d’hémorragie
- Sténoses ou diverticules œsophagiens, à cause du risque de rupture de l’œsophage.
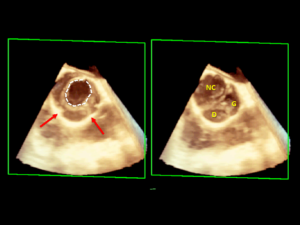
Figure 3: ETO/ image tridimensionnelle (3D). Valve aortique : malformation congénitale (valve unicuspide) avec soudure partielle des lignes d’ouverture de la valve (flèches). La valve aortique est constituée de 3 valvules sigmoïdes : D : sigmoïde droite ; G : sigmoïde gauche ; NC : sigmoïde non coronaire.
Qu’est ce qu’une fuite tricuspide ? :
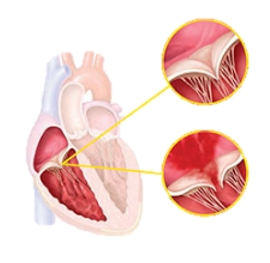
La valve tricuspide est un petit « clapet » séparant l’oreillette droite du ventricule droit. Cette valve s’ouvre pour laisser passer le sang et remplir le ventricule droit et se ferme au moment de l’éjection du ventricule droit vers l’artère pulmonaire. À l’état normal, elle ne laisse passer qu’une très petite quantité de sang vers l’oreillette droite lorsqu’elle est fermée .
L’insuffisance tricuspide (ou fuite tricuspide) est un défaut de fermeture des feuillets de la valve, entrainant un reflux de sang en quantité importante du ventricule droit dans l’oreillette droite pendant la phase d’expulsion du sang (systole).
Ce reflux entraîne une diminution du débit cardiaque, et une augmentation de pression dans l’oreillette droite aboutissant à terme à des symptômes d’insuffisance cardiaque (essoufflement, fatigue, œdèmes). Le foie et le rein peuvent souffrir de cette surpression (insuffisance rénale, engorgement du foie pouvant simuler une cirrhose hépatique)
Les pathologies de la valve tricuspide sont fréquemment associées aux pathologies des valves du cœur gauche mais aussi à l’arythmie chronique par fibrillation auriculaire.
Quel est le traitement de l’insuffisance tricuspide ? :
Le traitement des insuffisances tricuspide consiste à réparer (plastie) ou à remplacer la valve mitrale (prothèse) afin de corriger la fuite au cours d’une chirurgie cardiaque à cœur ouvert.
Il s’agit d’une chirurgie à risque élevé lorsqu’elle est proposée isolément.
Ce risque est évalué par une équipe médicale multidisciplinaire (cardiologues interventionnels, cardiologues cliniciens, cardiologues échographistes, chirurgiens cardiaques, anesthésistes et réanimateurs, gériatre ou médecin interniste), qui fait la synthèse de l’ensemble des antécédents du patient, et de son état général.
Dans quel cas proposer une correction par voie percutanée ?
Un système de réparation de la valve tricuspide par voie percutanée, passant par la veine fémorale, (système TRICLIP®), a été développé récemment
Le clip est connu et utilisé depuis de nombreuses années (2008) avec une efficacité prouvée pour corriger les fuites d’une autre valve cardiaque, la valve mitrale.
Des études préliminaires ont montré que la mise en place du dispositif était peu risquée et que la correction de la fuite tricuspide par clips pouvait améliorer les symptômes et la qualité de vie des patients atteints de fuite tricuspide.
D’autres études sont en cours de mise en place pour prouver son intérêt dans la diminution de la mortalité. La mise en place du dispositif ne nécessite pas d’ouverture chirurgicale du thorax.
Des critères techniques de faisabilité doivent par ailleurs être remplis pour bénéficier de cette technique (évaluation préalable par échographie Trans thoracique et Trans œsophagienne, par un médecin expert).
Comment se déroule l’intervention ? :
La procédure de pose du système est réalisée sous anesthésie générale par une équipe de médecins experts (cardiologues interventionnels).
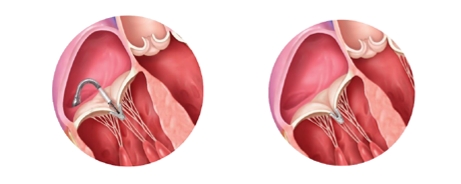
Le système TRICLIP® est introduit en passant par la veine fémorale en utilisant un cathéter (tuyau), amené jusqu’à la valve tricuspide en passant entre l’oreillette droite, puis en descendant sous la valve dans le ventricule droit.
Le système est ensuite attaché directement à la valve sous guidage échographique (trans-œsophagien et trans gastrique).
La mise en place de ce dispositif est réalisée grâce à un dispositif de fixation manipulable depuis l’extérieur du patient qui permet de positionner le clip avec précision. Ce système va attacher deux par deux les feuillets de la valve tricuspide pour réduire la fuite.
Vous serez hospitalisé pour une durée d’environ 3 à 7 jours.


 > Télécharger la fiche en PDF
> Télécharger la fiche en PDF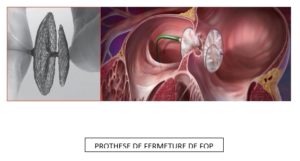 > Télécharger la fiche en PDF
> Télécharger la fiche en PDF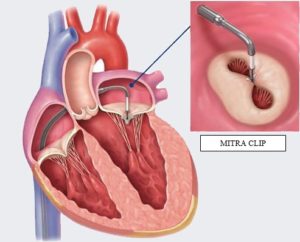 > Télécharger la fiche en PDF
> Télécharger la fiche en PDF